近日,貴州醫科大學高秀麗教授聯合軍事醫學研究鄭愛萍教授在《Bioactive Materials》雜志上發表了題為“Fc-empowered exosomes with superior epithelial layer transmission and lung distribution ability for pulmonary vaccination”的研究論文,該論文鑒于黏膜屏障的保護性質及其外泌體獨特的生物活性,對黏膜疫苗的策略進行了具體定制,通過肺部吸入的方式進行接種疫苗,間接增加了疫苗接種的依從性,并為未來潛在的流行性傳染疾病疫苗研發提供了新策略。《Bioactive Materials》為中科院一區期刊,影響因子為18.0。
新生兒Fc受體(FcRn)作為細胞膜上的IgG Fc部分受體,以pH依賴的方式結合并保護IgG轉胞吞于肺上皮,有效阻止其溶酶體降解,從而增長IgG的體內半衰期,并積極參與IgG的轉運、維持及代謝過程。近年來,Fc融合蛋白(免疫球蛋白分子的晶體可溶性碎片部分)通過將Fc片段與目標蛋白融合,因其能賦予新特性并增強穩定性和半衰期,而得到廣泛應用。在此背景下,本文介紹了一種創新的外泌體疫苗,該疫苗經過Fc功能蛋白修飾,利用DC(Dendritic Cell)來源的外泌體進行工程化改造。當氣管內接種時,這種疫苗能夠穿透肺上皮細胞上的FcRn受體,誘導產生高滴度的IgA抗體,并刺激組織駐留的記憶T細胞,從而誘導出顯著的肺黏膜免疫應答效果。軍事醫學研究院鄭愛萍教授、邢昊楠博后、貴州醫科大學高秀麗教授為共通訊作者,貴州醫科大學碩士研究生孟繁為該文章第一作者。
與腸外疫苗相比,黏膜疫苗具有潛在益處,因為它們可在病原體感染的主要部位觸發全身免疫保護和免疫應答。在本研究中,作者通過融合Fc和SARS-CoV-2受體結合域(RBD)與溶酶體相關膜蛋白2b (Lamp2b),設計了一種新型嵌合蛋白Fc-Lamp2b-RBD(F-L-R)。將編碼融合蛋白的質粒轉染DC2.4細胞后,外泌體的胞外區裝飾有Fc片段,胞內區裝飾有RBD片段。Fc通過FcRn介導的跨細胞轉運賦予外泌體良好的肺上皮傳遞能力,Lamp2b作為外泌體膜錨定物增加融合蛋白密度,RBD在激活抗病毒免疫反應中發揮重要作用,作者通過使用基因工程技術修飾外泌體,假設外泌體將更有效地穿過上皮層,從而引發更好的黏膜免疫反應。

通過對不同修飾的外泌體誘導的免疫效應的評估,作者深入了解了外泌體中Fc蛋白嵌合狀態對小鼠氣管內給藥的影響,以及不同接種方式引起的免疫應答的差異。當通過氣管給藥時,F-L-R-Exo引起了強大的細胞免疫反應,具有良好的穩定性和較高的抗原負載能力。此外,其在肺內的滯留時間延長,分布能力良好,與商業化的LNPs相比,F-L-R-Exo被證明是一種更先進的黏膜遞送系統。同時,通過氣管內給藥可使F-L-R-Exo穿透FcRn肺上皮細胞受體,從而激活黏膜免疫系統,誘導產生高滴度IgG抗體。這一過程還可觸發高滴度IgA抗體的產生,激活額外的抗原呈遞細胞,并刺激組織駐留的記憶T細胞,從而誘導全身免疫應答。
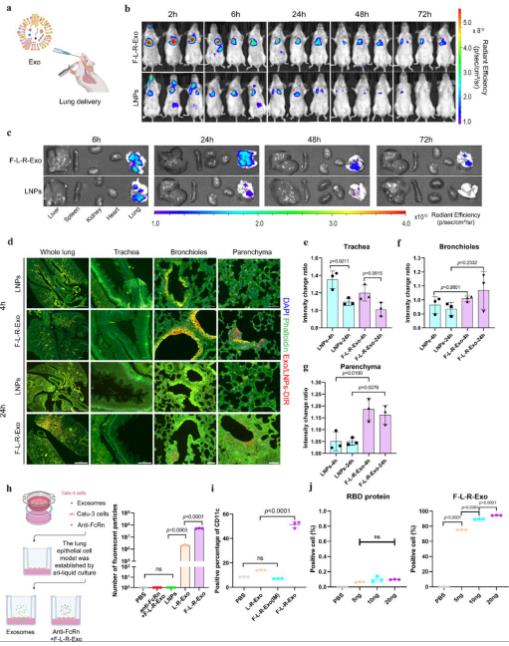
當疫苗通過呼吸道黏膜接種時,能夠巧妙地觸發黏膜免疫應答,這種應答在黏膜區域生成強大的分泌型免疫球蛋白及組織常駐記憶細胞,為身體構建起一道堅實的免疫屏障。總之,本研究創新性地提出了一種外泌體修飾方法,即利用Fc蛋白進行功能化修飾的F-L-R-Exo外泌體疫苗。F-L-R-Exo被證實為一種先進的黏膜疫苗,能夠穿透FcRn肺上皮細胞受體,有效激活黏膜免疫系統,誘導產生高滴度的IgG和IgA抗體。在當前情境下,有效的疫苗接種依然至關重要,通過吸入方式接種基于外泌體的工程化疫苗,不僅提升了疫苗接種的依從性,還在激發針對SARS-CoV-2的預防性和中和性抗體應答方面展現出了一定的臨床潛力。
參考文獻:
Fc-empowered exosomes with superior epithelial layer transmission and lung distribution ability for pulmonary vaccination.Bioact. Mater2024 Sep 12:42:573-586. doi: 10.1016/j.bioactmat.2024.08.015.











